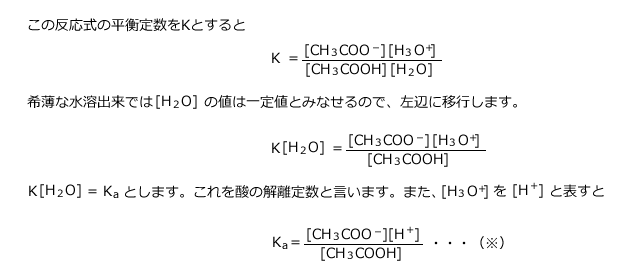
になっていますが、イオン反応式ではなく、化学反応式として書く必要があるため、 NH 4 Cl NaOH → NH 3 H 2 O NaCl さいごに 弱酸遊離・弱塩基遊離は、無機化学、有機化学を学ぶうえで基礎知識として必要となる話です。酢酸イオンの共鳴 酢酸イオンが、なぜ、CH 3 COO で安定になるかというと、上記の図のように 共鳴 (きょうめい、resonance)してるから。これまでに,化学平衡の例としては気体反応を用いたが,化学平衡の状態は気体反応だけでなく溶液中の反応においても見られる。 酢酸 ch 3 cooh のような弱酸が水に溶けると,一部が電離して,酢酸イオン ch 3 coo - と水素イオン h + が生成して,平衡状態
Http Www Eonet Ne Jp Nakacchi Renshu1 Pdf
化学式 酢酸イオン
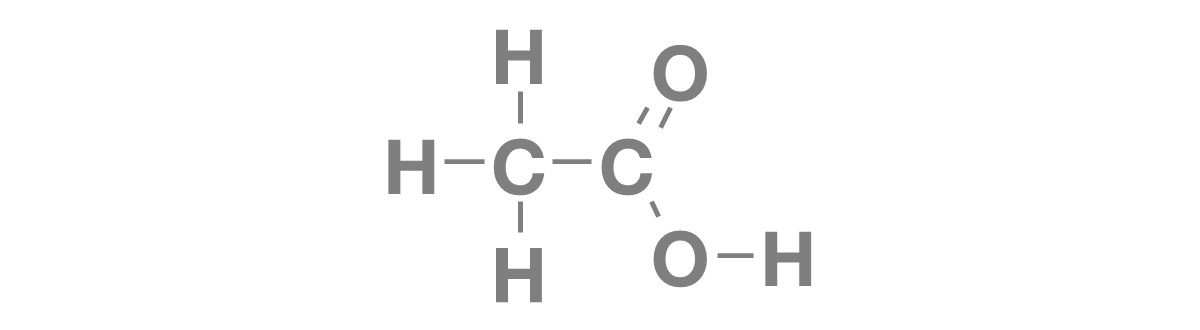
化学式 酢酸イオン- 酢酸のイオン解離と酸解離定数 酢酸(ch3cooh)は水溶液中では次の式のようなイオン解離が起こる。 ch3cooh h2o ⇄ ch3coo h3o この酢酸の酸解離定数は次の式で表すことができる。 分子式 c 6 h 8 o 7 は、クエン酸分子を構成する 原子の種類と数のみ を示し、分子構造や性質は伝えられない化学式です。 構造式 は分子構造、すなわち、 原子の繋がり方を示す 化学式です。 図を使用することで、分子の構造や性質を、一番わかりやすく表現できます。




有機化学 有機化学の化学結合 Wikibooks
塩として書くときには NaCH3COO のように書くこともありますよ。 一般にCH3COONaのように書くのはこれが示性式だからです。酢酸の化学式 分子式 構造式 電子式 イオン式 分子量は 酢酸の電離の反応式は 電離式の小テスト 3年理科 Takaの授業記録11 化学 科学 Pararinpoppin In Hell 高校化学 酢酸ナトリウムの加水分解 映像授業のtry It トライイットの酢酸ナトリウム水溶液のpHを求め なさい。ただし、酢酸の電離定数Ka =×105 mol/l、 水のイオン積K w=10×1014 mol2/l2、log =030と する。(文献4改題) 解答2 化学反応式 ch 3 co 2 na→ch 3 co 2+na ch 3 co 2+h 2 o⇄ch 3 co 2 h+ohch 3 co 2 h⇄ch 3 co 2+h h 2 o
14Seika12 生化学Ⅰ 第2回小テスト 問題1. i以下の酢酸のイオン化反応式(式1)において,Brønsted・Lowryの定義に従って「酸」Start studying イオン式、価電子数 化学 Learn vocabulary, terms, and more with flashcards, games, and other study tools 化学式の話です。 CH3CO3K (酢酸カリウム) C4H6CaO4 (酢酸カルシウム) のいい ベストアンサー: (CH3COO)2Caと覚えましょう。 酢酸イオンはCH3COOですから。
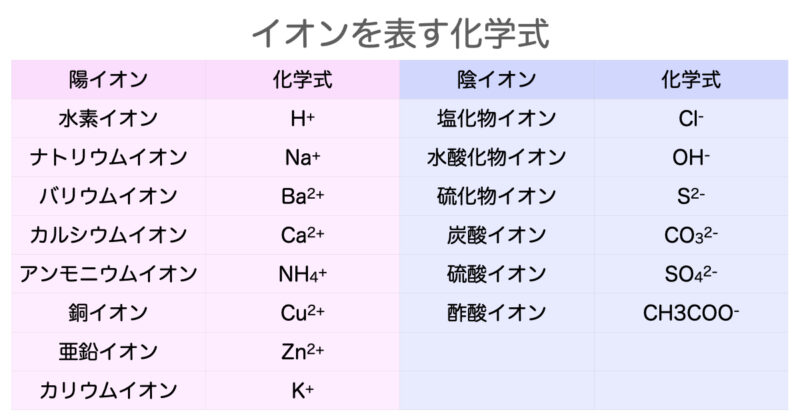
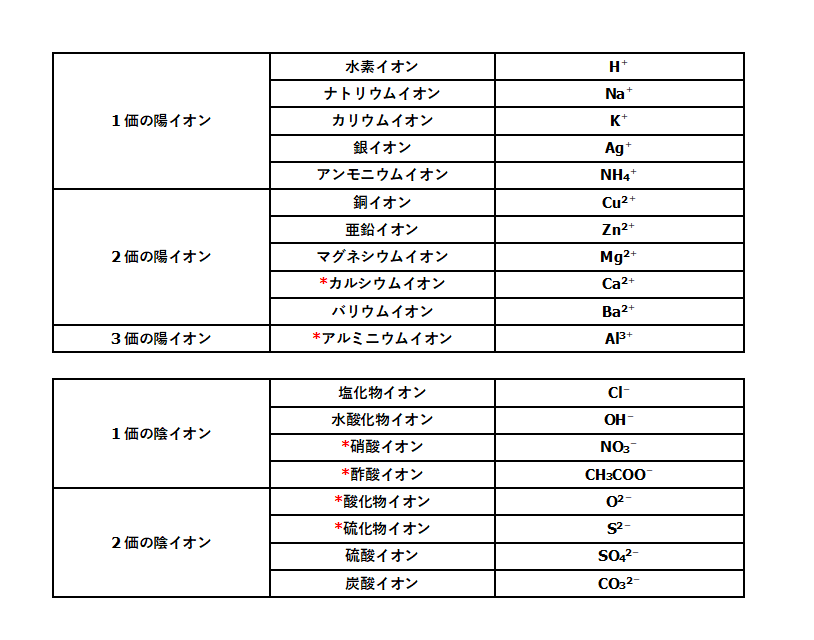
銀イオン 亜鉛イオン 硫酸イオン 水酸化物イオン nh 4 + cu2 2 co 3 - no 3- アンモニウムイオン 銅イオン 炭酸イオン 硝酸イオン 2 ba coo ch 3 - バリウムイオン 酢酸イオン 陽イオン 陰イオン 水素イオン h+ 塩化物イオン cl- 「酢酸を水に溶かした時の変化をイオン式で表せ」という問題なのですが、解答には上記の式が解答として記載されています。 この式を CH3COOH→H CH3COO前回 https//wwwyoutubecom/watch?v=JeSIo53P9Mo&index=2&list=PLKRhhk0lEyzO6hG1yNVv78DiG4yly4gL 次回 https//wwwyoutubecom/watch?v=W7jx1u9XlMY&index=4
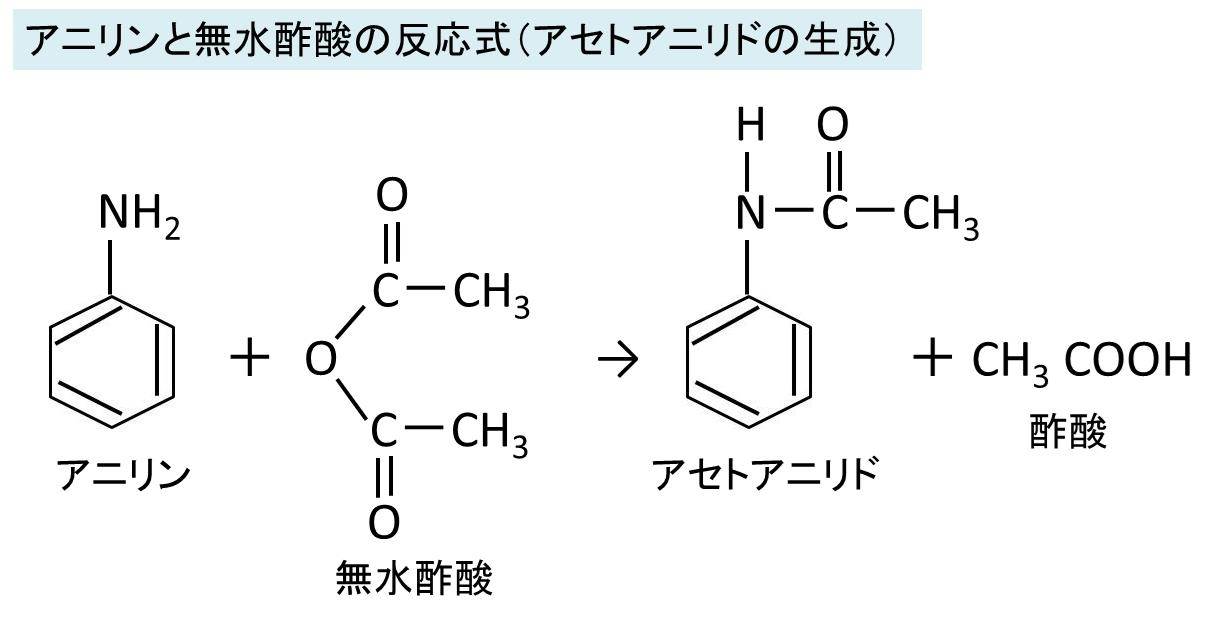



アニリンと無水酢酸の反応式 アセトアニリド生成 酢酸を使用しない理由は




103 Left 1right 010m01 See How To Solve It At Qanda
CO₃²⁻ CH₃COO⁻ みなさんこんにちは! このサイトを運営する「 さわにい 」といいます。 中学理科教育の専門家 です。 「 イオン式一覧と練習問題 」 ぜひ勉強に使ってください☆ そして、質問の多い「 イオン式と化学式の違い 」も簡単に解説します。 下の目次から好きなところ化学式(化学式→日本語) その2 * 「f」は? フッ化物イオン * 「o 2」は? 酸化物イオン * 「cl」は? 塩化物イオン * 「S 2」は? 硫化物イオン * 「no 3」は? 硝酸イオン * 「so 4 2」は? 硫酸イオン * 「po 4 3」は? リン酸イオン * 「ch 3 coo」は? 酢酸酢酸分子と酢酸イオンが多いほど 緩衝作用の能力は大きくなります。 学習アドバイス 「少量の強酸や強塩基を加えても,pHがあまり変化しない」。化学反応について学習を深めていけばいくほ ど,この緩衝液の性質は不思議に思えてきます。



受験基礎化学 19 化学反応式と物質量 みかみの参考書ブログ




これって丸暗記ですか Clear
正味のイオン式に関して最後に、均衡の取れた化学式は質量のみならず電荷も保存されねばなりません。 Mg HCl の正味イオン式では式の各辺で2 個の正電荷が存在します。左辺では2の全電荷に対して1の電 荷を持つ2 個のHイオンがあります書きたいのは酢酸の化学式ですよね。 酢酸CH3COOH イオンによる構造を明らかにするためにそのような表記をしています。 分解するときには化学式の最後の2文字であるOHがOH(水酸化物イオン)としてほかの物質に結合します。 Hirokikiです。 今回は共鳴構造について学んでいきましょう。 共鳴構造は、一言で言うと電子が局所的にどの原子に存在しているのかを表した構造のことです。 酢酸イオンを用いて説明していきたいと思います。 酢酸イオンの共鳴構造を図1に示します。 図1




硫酸イオンと 硫酸の化学式はなぜ違うのですか 硫酸にはなぜhがつくのに 硫酸イ アンサーズ



化学基礎の酸と塩基が中和反応するときの化学反応式について 反 Yahoo 知恵袋
化学 酢酸ナトリウムが電離して生じた酢酸イオンch3coo^ が加水分解するとき、 CH3COO^-+H2O ⇔ CH3COOH + OH^- の平衡が成り立ちます。このとき、平衡がかなり左に寄そのため,水素イオン濃度は小さくなる.たとえば,酢酸ナトリウムは水溶液中でほとんど完全に解離する. CH 3 COONa → CH 3 COO Na すると,酢酸の電離平衡4次の熱化学方程式が表わしている内容を文章で表せ。 (1)CO(気)+H 2 O(気)=CO 2 (気)+H 2 (気)+412kJ/mol (2)H aq+OH aq=H 2 O(液)+565kJ




イオン式とは 価数とは 書き方や語呂合わせの覚え方 暗記法まとめ 高校化学の問題の解き方も 受験の相談所




2 2 3 電離平衡
1 ジアミン銀(Ⅰ)イオン Ag(NH 3) 2 + 2 テトラアンミン銅(Ⅱ)イオン Cu(NH 3) 4 2+ 2 テトラアンミン亜鉛イオン Zn(NH 3) 4 2+ 1 テトラヒドロキソアルミン酸イオン Al(OH) 4 ー 4 テトラヒドロキソ亜鉛酸イオン Zn(OH) 4 4ー 41価 水酸化物イオン oh - 硝酸イオン no 3 - 酢酸イオン ch 3 coo - シアン化物イオン cn - 炭酸水素イオン hco 3 - 硫酸水素イオン hso 4 - 過マンガン酸イオン mno 4 - 過塩素酸イオン clo 4 - 塩素酸イオン clo 3 - 酢酸及び酢酸イオンの表記について、いちいち化学式で書くのは面倒なので、酢酸(CH 3 COOH)をAH, 酢酸イオン(CH 3 COO)をAと書くことにする。ちなみにAはacidの略。したがって、K a についての式は次のように書き直される。 酢酸の全濃度をCとすると、




電離式の一覧 中学生用
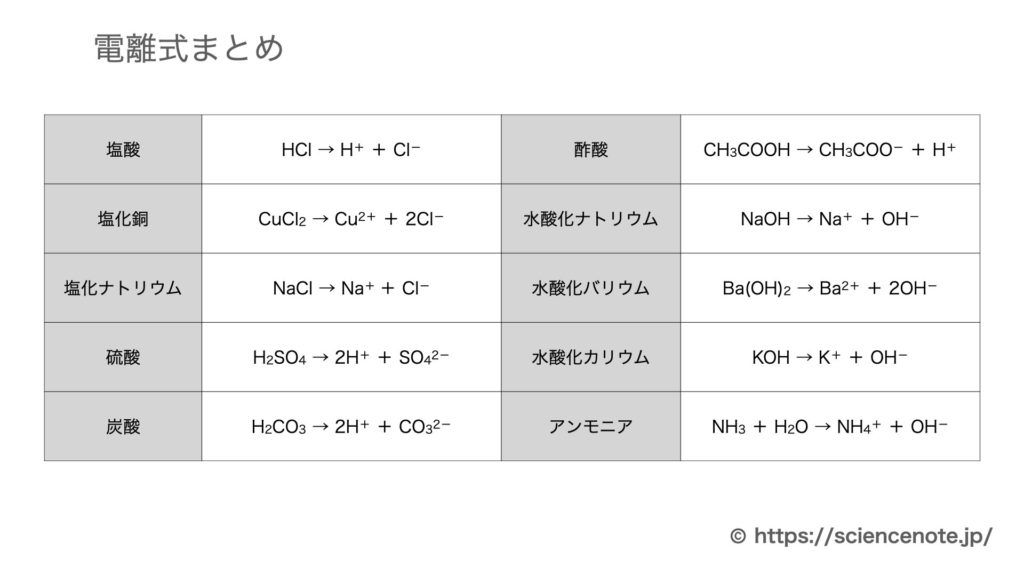



電離とは 電離式まとめ10選 中学化学 Sciencenote Jp
酢酸 CH3COOH ⇔ (CH3COO) (H)、水 H2O ⇔ (H) (OH) 酸、塩基、塩の化学式では、HCl、NaOH、NaClのように陽イオンを先に陰イオンを後に書きます。 そのため、電離平衡の式でも陽イオンを先に書くのが普通です(HCl ⇄ H Cl)。 酢酸のような有機化合物では分子の構造が分かり易いように、分子式から官能基(酢酸の場合、COOH)を抜き出して示す示性式(酢酸の場合化学反応式の対策をするためには、まず元素記号と化学式をしっかり覚えましょう。 例えば下記のような化学式です。 水素→H2 塩素→CI2 窒素→N2 酸素→o2 元素記号と化学式を覚えていなければ化学反応式は書けません。*A ☞「ctrl」「F」で、検索できます。 Ac アクチニウムactinium Ac 227 半減期218年 Ac- 酢酸イオンacetate ion Ag 銀silver 47Ag(2 8 18 18 1) 面心立方格子facecentered cubic lattice Ag 銀イオンsilver ion AgAc 酢酸銀silver acetate Ag3AsO3 亜ヒ酸銀silver arsenite Ag3AsO4 ヒ酸銀silver arsenate AgBO3 メタホウ酸銀silver metaborate AgBr
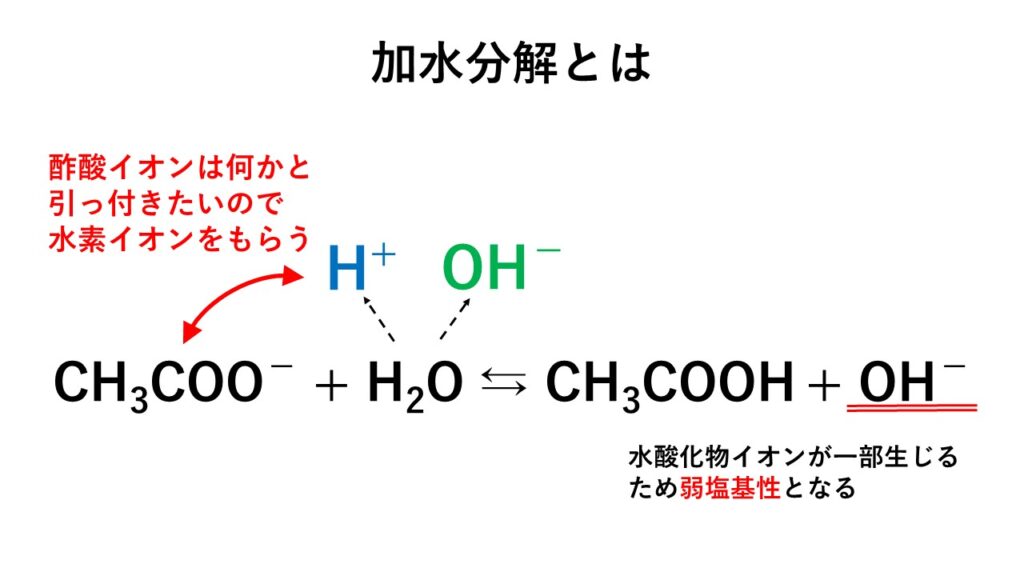



5分でわかる 塩の加水分解と塩の種類と分類 液性を解説 サイエンスストック 高校化学をアニメーションで理解する




Excel イオン式 電離式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ
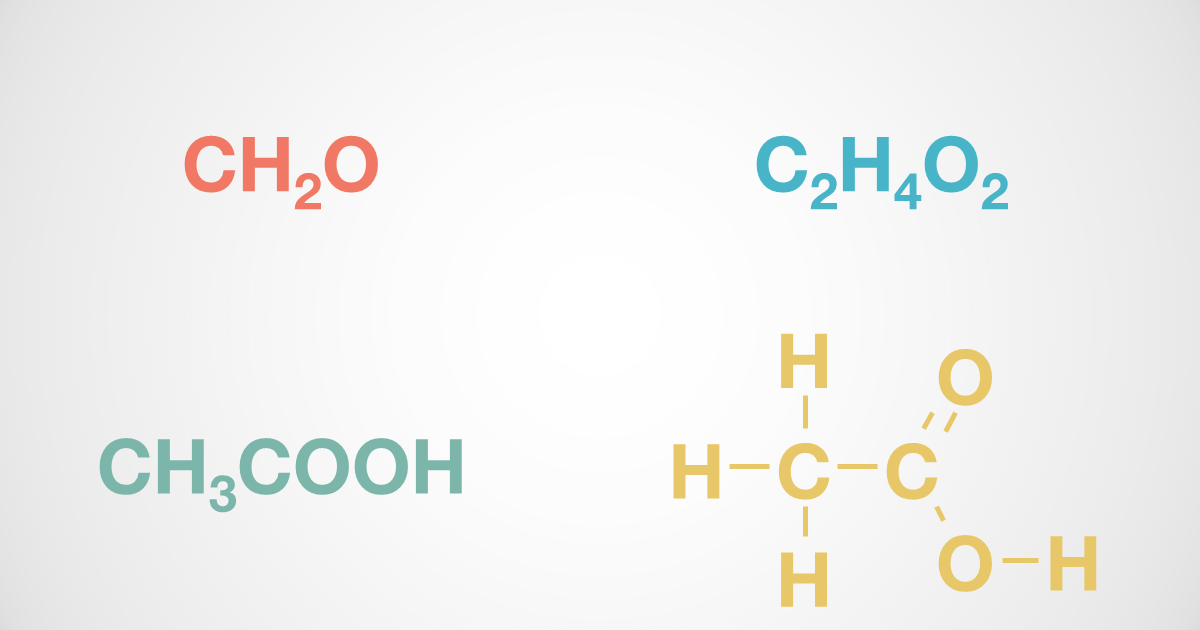
酢酸ナトリウムは塩なので、完全に電離する。(上の式) 酢酸も(電離度を考慮しなくてはならないが)電離する。(下の式) しかし、これらが混合液になったとき、普段とは少し異なった反応を示す。 酢酸ナトリウムの方は、通常通り電離する。 \Start studying 化学 イオン 化学式 Learn vocabulary, terms, and more with flashcards, games, and other study tools2/13分子式 基本となる分子式は,確実に暗記してしまおう。 ・メタノール,エタノール,酢酸,シュウ酸の分子式は,ch4o,c2h6o,c2h4o2,h2c2o4である。 ・ch3oh,c2h5oh,ch3cooh,(cooh)2は示性式(官能基が分かるように書いた化学式)である。 ・分子式では構造が特定できないので,有機化合物は




いろいろな化学式 化学基礎



Http Www Eonet Ne Jp Nakacchi Renshu1 Pdf




組成式とは 分子式との違いも解説 一覧表つき 高校生向け受験応援メディア 受験のミカタ




化学式 物質の表し方のいろいろ 図解でわかる危険物取扱者講座




イオン式の覚え方とかあったら教えていただけると助かります お願いします Clear




電離平衡 緩衝液のしくみと働きについて教えてください 化学 定期テスト対策サイト




Excel イオン式 電離式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ
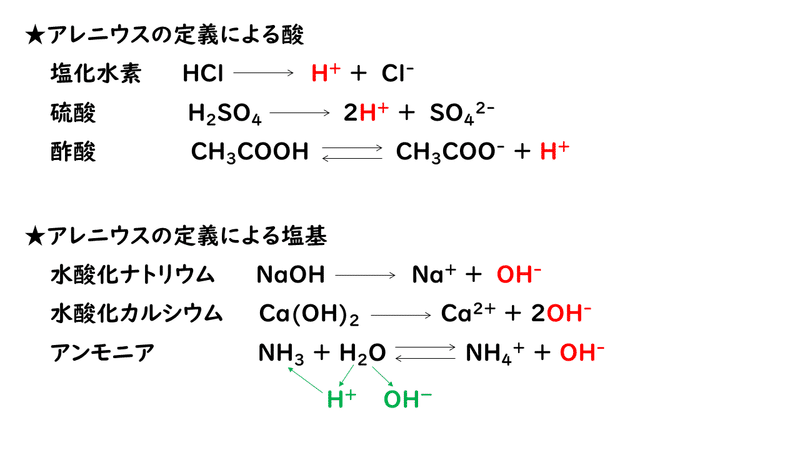



6 1 酸と塩基 おのれー Note
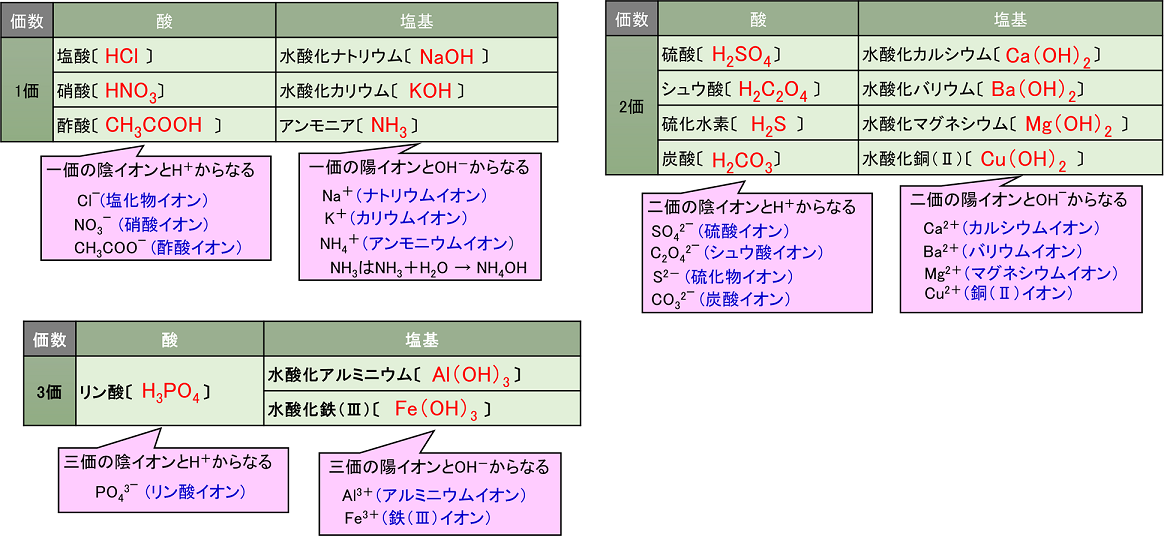



酸と塩基




103 Left 1right 010m01 See How To Solve It At Qanda
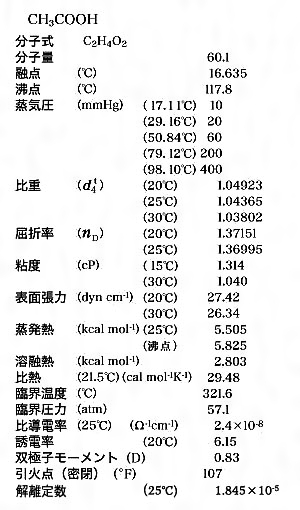



酢酸とは コトバンク
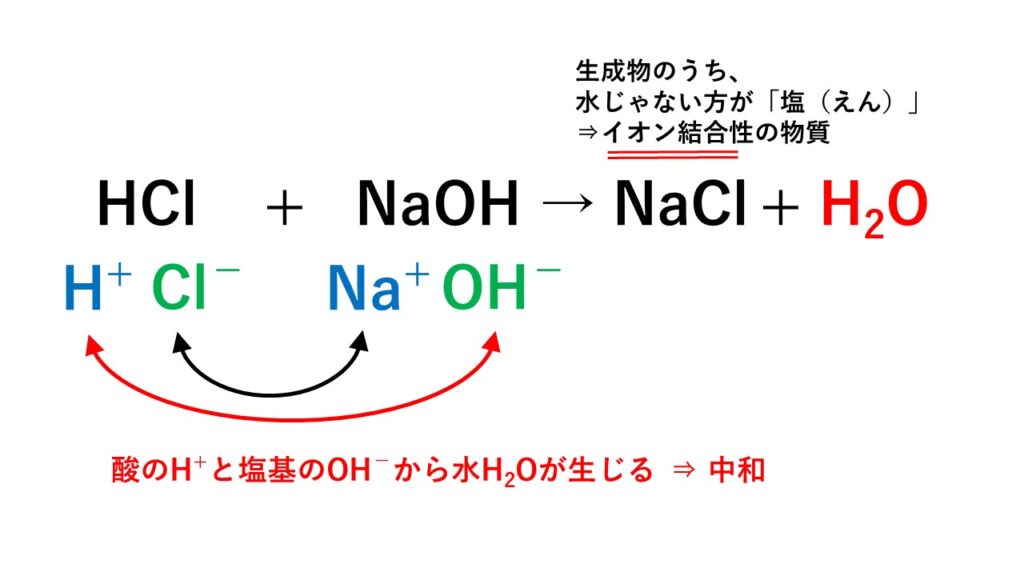



5分でわかる 中和反応とは 化学反応式と計算問題の解き方 練習問題付き サイエンスストック 高校化学をアニメーションで理解する
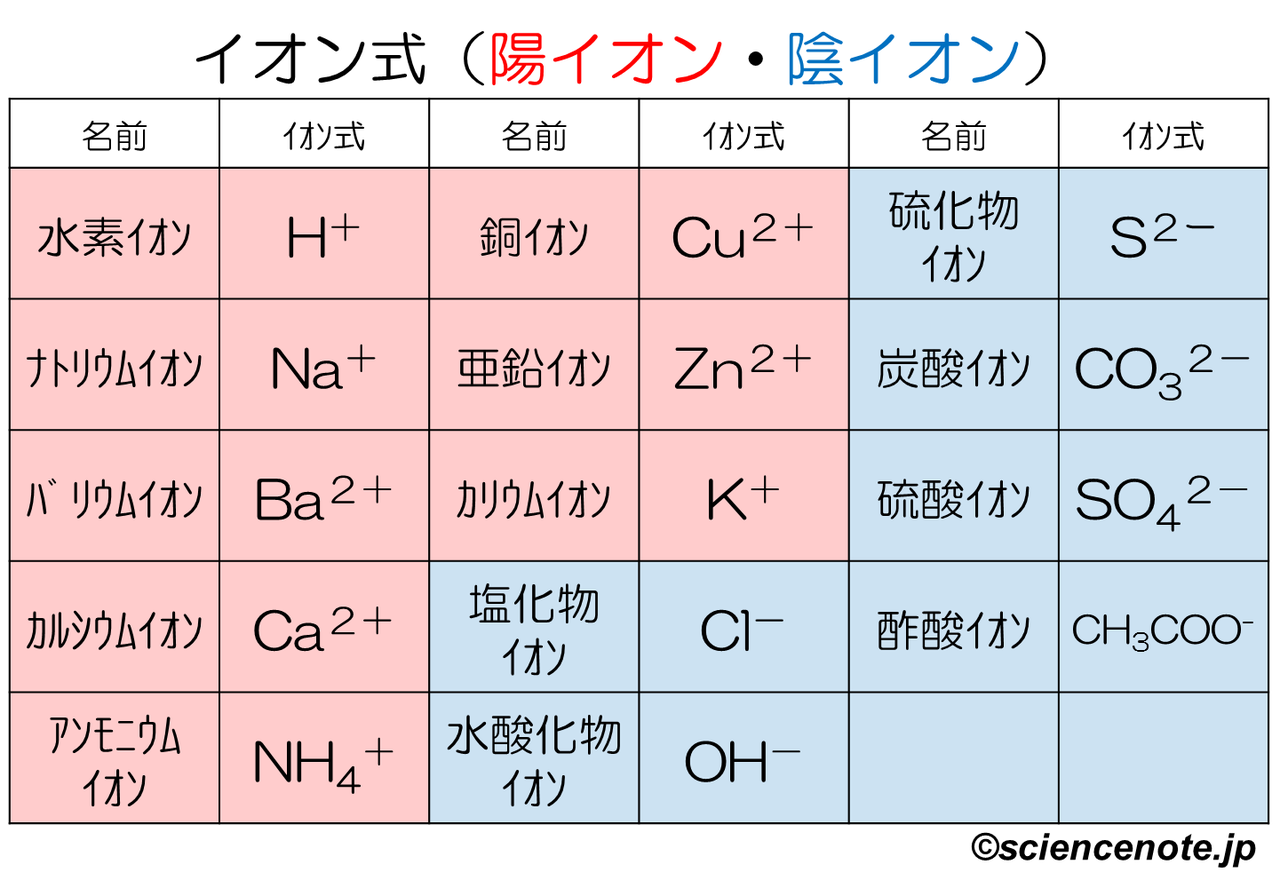



これだけは覚えたいイオンを表す化学式まとめ 中学理科 Sciencenote Jp
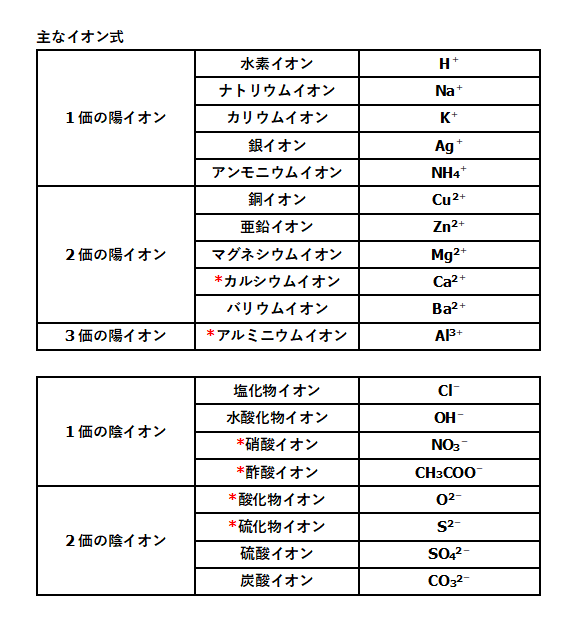



イオン式 電離式まとめ 中学理科 ポイントまとめと整理




化学式




Excel イオン式 電離式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ




高校化学基礎 酸の価数 映像授業のtry It トライイット
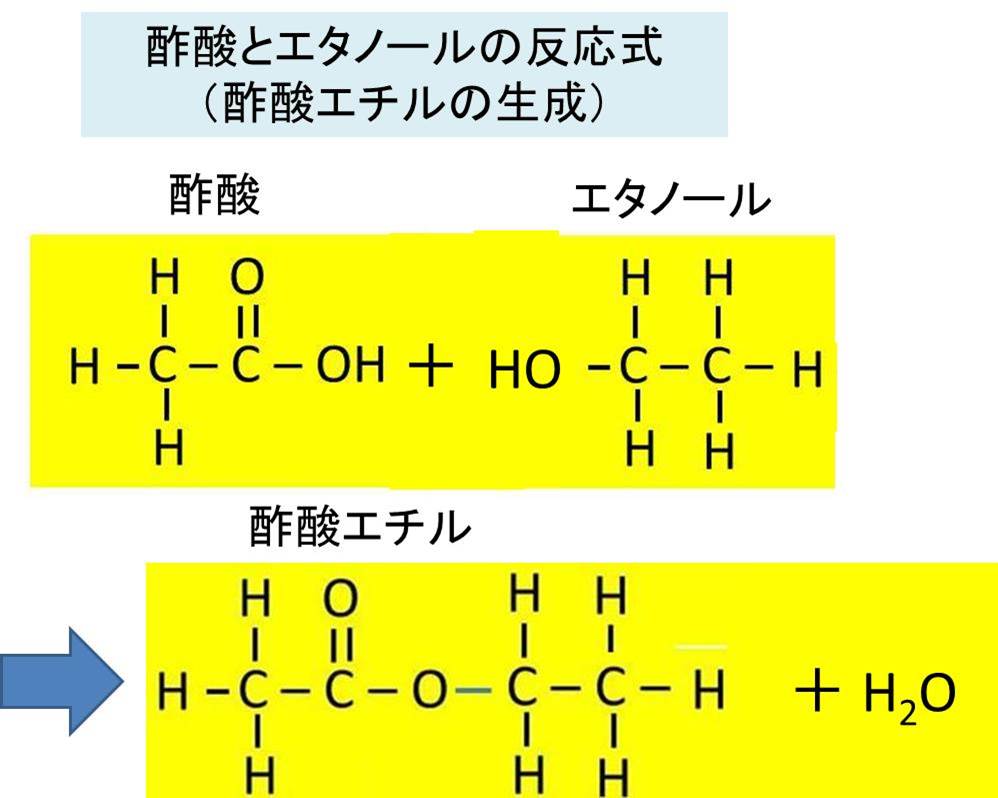



酢酸とエタノールやアセチレンとの反応式




イオン結合とイオンからなる物質




番を教えてください Clear




分子に酢酸のモルが来ることでなぜ酢酸ナトリウムのモル濃度が求められるのですか 1 Clear




4 1 Hci 2 H2so4 3 Hn Lihat Cara Penyelesaian Di Qanda




レツレ ルッコラーノ54世 酢酸イオンの化学式難しすぎでしょ 省くぞ
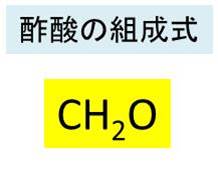



酢酸の化学式 分子式 構造式 電子式 イオン式 分子量は 酢酸の電離の反応式は




酢酸イオンだけ水素イオンとくっついて なんでナトリウムイオンと水酸 大学受験 教えて Goo



電離式の小テスト 3年理科 Takaの授業記録11




有機化学 有機化学の化学結合 Wikibooks




酢酸の化学式はch3coohで 酢酸イオンのイオン式はch3coo になる意味が アンサーズ
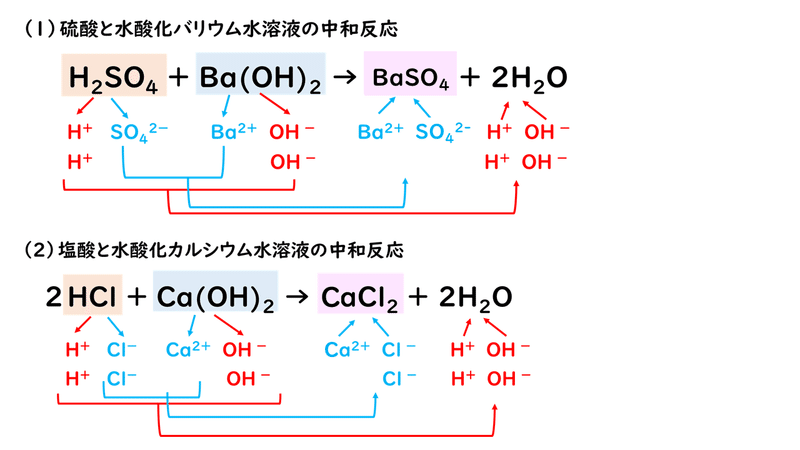



6 4 塩とその性質 おのれー Note



この酢酸マグネシウム 組成式 酢酸イオンとマグネシウムイオン逆じゃな Yahoo 知恵袋




授業に潜入 おもしろ学問 自然科学科目群 化学 化学概論 I 中村敏浩 教授 京都大学広報誌 紅萠




酢酸0 1mol L 10ml 水酸化ナトリウム0 1mol L 4mlの混合溶液の水素イオ 化学 教えて Goo




電離式の一覧 中学生用




高校化学基礎 水素イオン濃度とは 映像授業のtry It トライイット
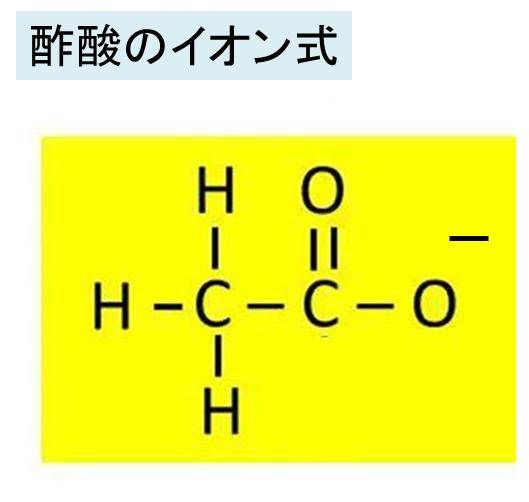



酢酸の化学式 分子式 構造式 電子式 イオン式 分子量は 酢酸の電離の反応式は




イオン式 電離式まとめ 中学理科 ポイントまとめと整理




4 教えて欲しいです 酢酸水溶液 はch3coohなのか Ch3cooh Clear




有機化学 有機化学の化学結合 Wikibooks



5分でわかる 中和反応とは 化学反応式と計算問題の解き方 練習問題付き サイエンスストック 高校化学をアニメーションで理解する
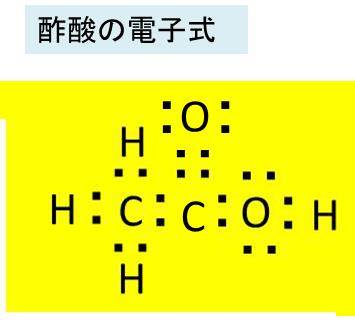



酢酸の化学式 分子式 構造式 電子式 イオン式 分子量は 酢酸の電離の反応式は




2枚の画像にあるような化学式についてなのですが 矢印が Clear




酢酸分子と 酢酸イオンの違いってなんですか Clear
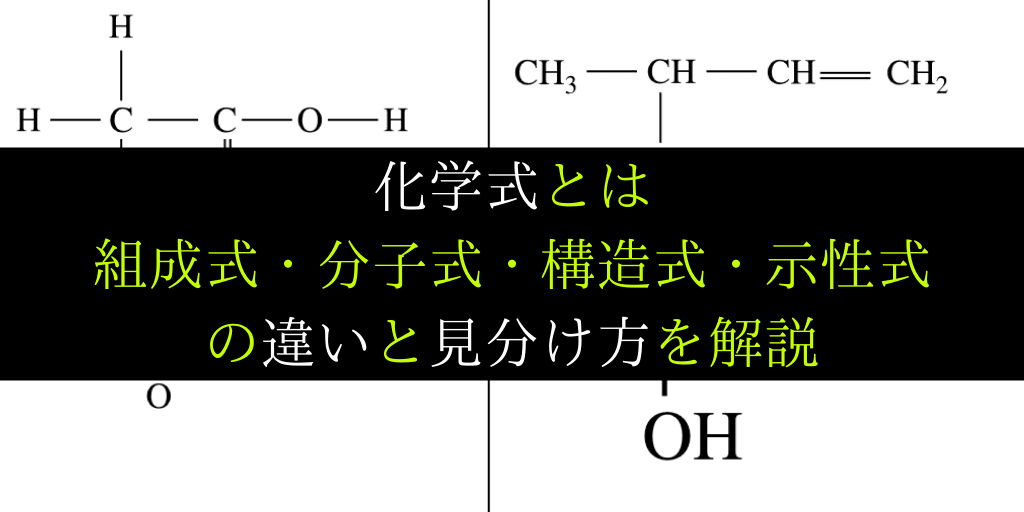



化学式 組成式 分子式 示性式 構造式の違いと見分け方を具体例で解説




イオン反応式とは 裏ワザ的書き方を徹底解説 化学受験テクニック塾




1 で 酢酸カリウムの化学式をkを先に書いたのですが 答えは後ろでした どうしてで Clear



Q Tbn And9gctb8ijwcm63fcfjsm5tir4yzhv6qx 5ze Vofqrzxdmppu Mmag Usqp Cau




酢酸の電離式についてなのですが 私はh をはじめに書いたのですが 答えは後ろにしてい Clear



イオン反応式で答える問題は 普通の化学反応式からどれくらい省略すればい Yahoo 知恵袋



受験基礎化学 19 化学反応式と物質量 みかみの参考書ブログ



酸と塩基 電離平衡



1




電離式の一覧 中学生用



酢酸鉛 Ii You Iggy



酸と塩基 酸と塩基の強さ



化学式 物質の表し方のいろいろ 図解でわかる危険物取扱者講座




エチレンジアミン四酢酸 Wikipedia




化学式 物質の表し方のいろいろ 図解でわかる危険物取扱者講座




高校化学 酢酸ナトリウムの加水分解 映像授業のtry It トライイット



このようになぜ酢酸だけ酸なのに化学式が前に来るんですか 結論を言 Yahoo 知恵袋
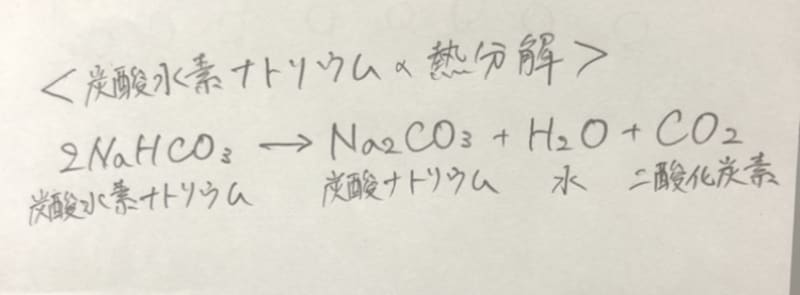



炭酸水素ナトリウムの化学反応式を教えてください アンサーズ



酢酸 You Iggy



化学講座 第56回 化学反応速度 弱酸 弱塩基の電離 私立 国公立大学医学部に入ろう ドットコム




2枚の画像にあるような化学式についてなのですが 矢印が Clear



2




都立高校入試における化学反応式の傾向と対策とは 重要な式を覚えて得点源にしよう 高校入試徹底対策ガイド



2 o 問1 次の各化学反応式に係数を入れよ



これだけは覚えたいイオンを表す化学式まとめ 中学理科 Sciencenote Jp




103 Left 1right 010m01 See How To Solve It At Qanda




酢酸分子と 酢酸イオンの違いってなんですか Clear




これだけは覚えたいイオンを表す化学式まとめ 中学理科 Sciencenote Jp




010 M0ll 100 Ml 0 Mol Descubre Como Resolverlo En Qanda




組成式とは 分子式との違いも解説 一覧表つき 高校生向け受験応援メディア 受験のミカタ



イオン結合とイオンからなる物質



酢酸 Wikipedia



塩の加水分解 化学基礎 高校化学net参考書




このいい覚え方があったら教えてください Clear




いろいろな化学式 化学基礎
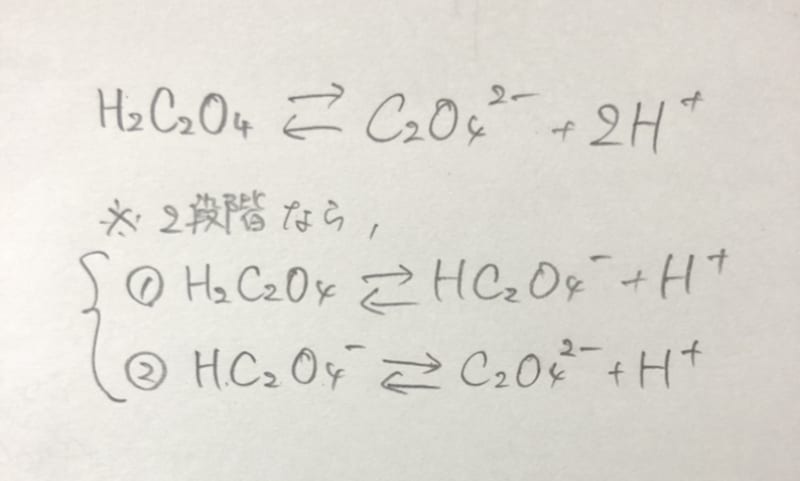



シュウ酸の電離式を教えてください アンサーズ



化学式 物質の表し方のいろいろ 図解でわかる危険物取扱者講座




強酸と弱酸まとめ 見分け方 理系ラボ



組成式の作り方について プラス マイナスのイオンの比で右上の数字が比 Yahoo 知恵袋



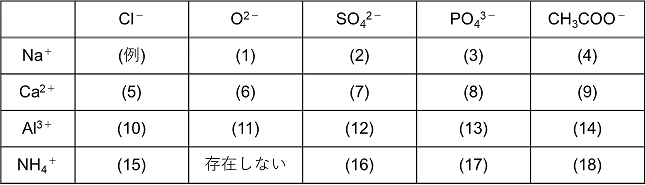
中3化学 イオンとは 中学理科 ポイントまとめと整理




6 1 酸と塩基 おのれー Note
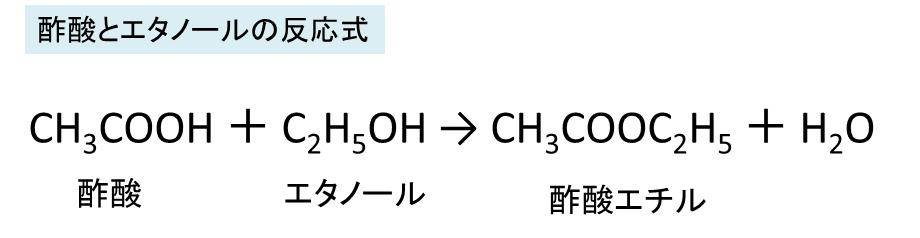



酢酸とエタノールやアセチレンとの反応式



酢酸イオンと水分子との反応では可逆反応を起こすのに対し酢酸ナ Yahoo 知恵袋
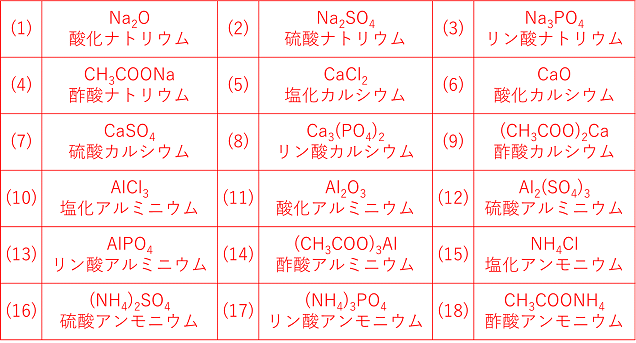



イオン結合とイオンからなる物質




1 Squar Lihat Cara Penyelesaian Di Qanda



3




イオン式 電離式まとめ 中学理科 ポイントまとめと整理



3
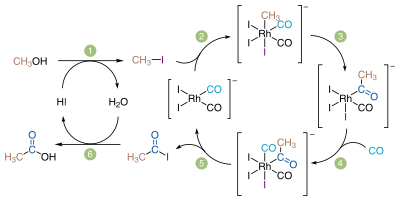



酢酸 Wikipedia




高校化学 酢酸ナトリウムの加水分解 映像授業のtry It トライイット


